QUIMICA 11-3
viernes, 17 de noviembre de 2017
domingo, 12 de febrero de 2017
domingo, 30 de octubre de 2016
GASES

LABORATORIO DE GASES

Acontinucion trataremos el temas sobre los gases, en el cual realizamos un laboratorio,el cual podremos observar y practicar sus diversas aplicaciones, ademas de conocer las diferentes leyes y conceptos vitales para realizar los ejercicios correctamente,las principales características de las diferentes disoluciones como las leyes de boyle , charles, la ley estado, la combinada para los gases y la solubilidad.
OBJETIVOS:
- Conocer y diferenciar los diversos conceptos de gases.
- Conocer y diferenciar las Leyes de los Gases.
- Saber ante qué circunstancias se debe aplicar cada Ley.
- Conocer las propiedades de los gases.
- Realizar correctamente cada ejercicio de acuerdo a las indicaciones y características que presente el gas para así mismo hallar la variable que se nos está solicitando.
- Conocer y diferenciar las fórmulas de cada Ley.
- Emplear principios matemáticos básicos (despejar ecuaciones).
- Utilizar correctamente la calculadora y reconocer sus respectivas funciones.
- Reforzar los conocimientos previos acerca de estas Leyes.
MARCO TEÓRICO:
- ¿QUE ES UN GAS?
Se denomina gas al estado de agregación de la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta concentración de energía cinética. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.

A temperatura y presión ambientales los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles, compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
- LOS GASES SE COMPORTAN:
Los gases han tenido siempre un gran atractivo para los científicos. Tienen propiedades que los hacen muy diferentes a los líquidos y sólidos. Parecen casi inmateriales pero si experimentamos con cuidado podemos medir su masa, que desde luego es muy pequeña. Asó un litro de aire pesa solo 1g, mientras que un litro de agua pesa 1000g.

Lo cual tiene como consecuencia que:

Algunos gases son explosivos, otros apagan el fuego, unos son venenosos para nosotros mientras que otros no son indispensables para vivir.
Hace más o menos 250 años los científicos dispusieron de instrumentos suficientemente precisos para estudiar los gases. En esa época ya tenían termómetros, balanzas de precisión, compresores y extractores, y se dispusieron a estudiar los gases.

Comenzamos con el científico inglés Robert Boyle.
En el cuadro podemos ver un científico, rodeado un grupo numeroso de personas (posiblemente familiares y amigos), realizando un experimento.
Han encerrado un pájaro en un vasija de vidrio y están extrayendo el aire de su interior. En pocos segundo el pájaro muere y una mujer vuelve la cabeza aterrada.
Se demostraba así la necesidad del gas que nos rodea para la vida.
Aparte de estos experimentos, que repitieron con otros seres vivos, Robert Boyle es famoso por haber encontrado la primera ley conocida sobre los gases.
Para entender mejor el comportamiento de un gas siempre se realizan estudios con respecto al gas ideal aunque este en realidad nunca existe y las propiedades de este son:
- Un gas está constituido por moléculas de igual tamaño y masa, pero una mezcla de gases diferentes, no.
- Se le supone con un número pequeño de moléculas, así su densidad es baja y su atracción molecular es nula.
- El volumen que ocupa el gas es mínimo, en comparación con el volumen total del recipiente.
- Las moléculas de un gas contenidas en un recipiente, se encuentran en constante movimiento, por lo que chocan, ya entre sí o contra las paredes del recipiente que las contiene.
- LEY DE LOS GASES IDEALES:
Según la teoría atómica las moléculas pueden tener o no cierta libertad de movimiento,en el espacio.estos grados de libertad microscópicos están asociados con el orden microscópico.
Se han desarrollado leyes empíricas que relacionan las variables microscópicas en base a las experiencias en laboratorio realizadas. en los gases ideales, estas variables incluyen la presión (p), el volumen (v) y la temperatura (t).
- LEYES:
- LEY DE AVOGADRO:
La Ley de Avogadro es una ley de los gases que relaciona el volumen y la cantidad de gas a presión y temperaturas constantes.
En 1811 Avogadro realiza los siguientes descubrimientos:
- A presión y temperatura constantes, la misma cantidad de gas tiene el mismo volumen independientementedel elemento químico que lo forme
- El volumen (V) es directamente proporcional a la cantidad de partículas de gas (n)
Lo cual tiene como consecuencia que:
- Si aumenta la cantidad de gas, aumenta el volumen
- Si disminuye la cantidad de gas, disminuye el volumen
- Ley de boyle
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión: PV=k\,
donde k\, es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. El valor exacto de la constante k no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
donde k\, es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. El valor exacto de la constante k no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
P_1V_1=P_2V_2\,
Además se obtiene despejada que:
P_1=P_2V_2/V_1\,
V_1=P_2V_2/P_1\,
P_2=P_1V_1/V_2\,
V_2=P_1V_1/P_2\,
Donde:
P_1\,= Presión Inicial
P_2\,= Presión Final
V_1\,= Volumen Inicial
V_2\,= Volumen Final
Además se obtiene despejada que:
P_1=P_2V_2/V_1\,
V_1=P_2V_2/P_1\,
P_2=P_1V_1/V_2\,
V_2=P_1V_1/P_2\,
Donde:
P_1\,= Presión Inicial
P_2\,= Presión Final
V_1\,= Volumen Inicial
V_2\,= Volumen Final
- Ley de charles
es una de las leyes de los gases. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenida a una presión constante, mediante una constante de proporcionalidad directa.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energía cinética debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.


- LEY DE GAY-LUSSAC:
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800. Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante. La presión del gas es directamente proporcional a su temperatura: Si aumentamos la temperatura, aumentará la presión
- ESTADOS DE AGREGACIÓN:

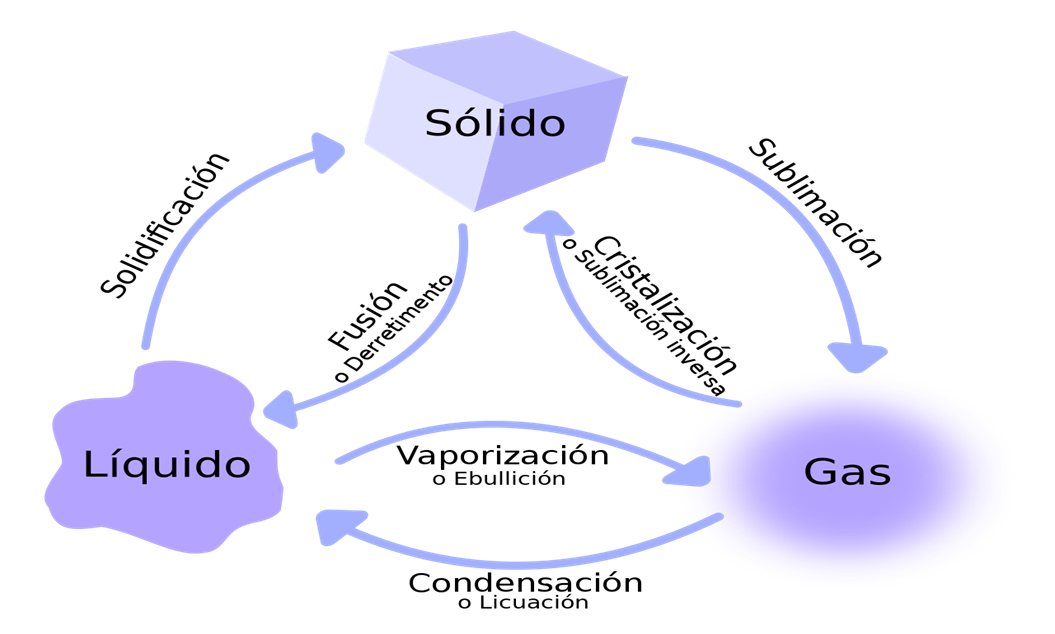
La materia se presenta en tres estados o formas de agregación: sólido, líquido y gaseoso.
Dadas las condiciones existentes en la superficie terrestre, sólo algunas sustancias pueden hallarse de modo natural en los tres estados, tal es el caso del agua.La mayoría de sustancias se presentan en un estado concreto. Así, los metales o las sustancias que constituyen los minerales se encuentran en estado sólido y el oxígeno o el CO2 en estado gaseoso:
Dadas las condiciones existentes en la superficie terrestre, sólo algunas sustancias pueden hallarse de modo natural en los tres estados, tal es el caso del agua.La mayoría de sustancias se presentan en un estado concreto. Así, los metales o las sustancias que constituyen los minerales se encuentran en estado sólido y el oxígeno o el CO2 en estado gaseoso:
- Los líquidos: No tienen forma fija pero sí volumen. La variabilidad de forma y el presentar unas propiedades muy específicas son características de los líquidos.
- Los gases: No tienen forma ni volumen fijos. En ellos es muy característica la gran variación de volumen que experimentan al cambiar las condiciones de temperatura y presión.
- Los sólidos: Tienen forma y volumen constantes. Se caracterizan por la rigidez y regularidad de sus estructuras.
- Si la temperatura aumenta, los sólidos y los líquidos se dilatan.
- Si la temperatura disminuye, los sólidos y los líquidos se contraen.
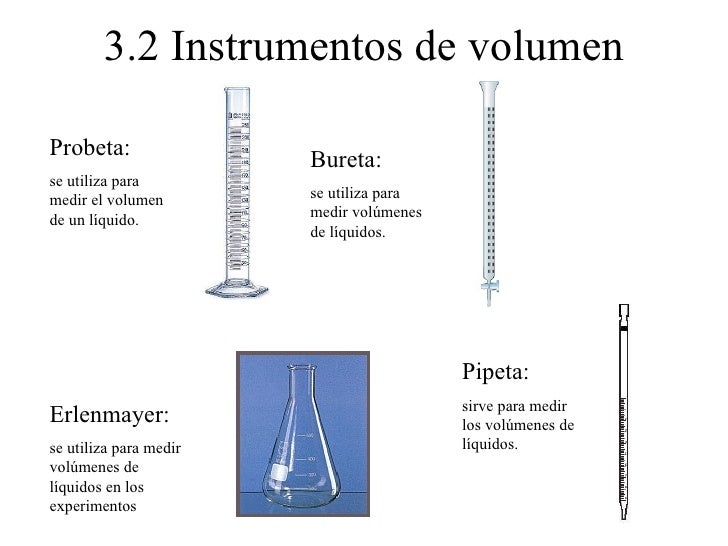
- Para medir el volumen de un líquido se pueden utilizar instrumentos como un vaso precipitado, probeta, pipeta, matraces, entre otros.
- Para medir el volumen de un sólido irregular, se puede utilizar el método por inmersión en agua. Así el volumen del solido será la diferencia entre el volumen final, que se mide cuando el objeto está dentro de una probeta, menos el volumen inicial.
- Para medir el volumen de un sólido geométrico se suelen utilizar formulas matemáticas. Por ejemplo para medir el volumen de una esfera, un cubo, o un cilindro se utilizan las siguientes formulas.
Temperatura:
La Temperatura es una propiedad de la materia que está relacionada con la sensación de calor o frío que se siente en contacto con ella. Cuando tocamos un cuerpo que está a menos temperatura que el nuestro sentimos una sensación de frío, y al revés de calor. Sin embargo, aunque tengan una estrecha relación, no debemos confundir la temperatura con el calor.
Cuando dos cuerpos, que se encuentran a distinta temperatura, se ponen en contacto, se produce una transferencia de energía, en forma de calor, desde el cuerpo caliente al frío, esto ocurre hasta que las temperaturas de ambos cuerpos se igualan. En este sentido, la temperatura es un indicador de la dirección que toma la energía en su tránsito de unos cuerpos a otros.
convertir temperaturas:
K= °C + 273 (Grados Celsius a grados Kelvin)
°F= 9/5 °C + 32 (Grados Centígrados a grados Fahrenheit)
°C= 5/9 °F - 32 (Grados Fahrenheit a grados Celsius)
R= °C +453 (Grados Celsius a Rankine)
°F= 9/5 °C + 32 (Grados Centígrados a grados Fahrenheit)
°C= 5/9 °F - 32 (Grados Fahrenheit a grados Celsius)
R= °C +453 (Grados Celsius a Rankine)
Se le llama Presión, a la reacción inmediata que ejerce un cuerpo sobre otro en relación de peso o fuerza. La presión técnicamente se refiere a dos tipos fundamentales, opresión y compresión, la opresión es comúnmente asociada a la falta de libertad de un sujeto para movilizarse con plena independencia, y la compresión se refiere al esfuerzo o impedimento que realiza un cuerpo sobre otro impidiendo su salida de algún sitio.
La presión de cierto vapor o gas puede provocar la ruptura de algún reactor, asi como también en algún instrumento de medición puede arrojar datos relevantes de cualquier estudio. La presión es básicamente usada para determinar procesos en los que la temperatura juega un papel fundamental en la realización de algún experimento con una reacción química.
La presión de un gas se observa mediante la medición de la presión externa que debe ser aplicada a fin de mantener un gas sin expansión ni contracción.
Volumen:
El volumen corresponde a la medida del espacio que ocupa un cuerpo. La unidad de medida para medir volumen es el metro cubico (m3), sin embargo generalmente se utiliza el Litro (L).
El metro cubico corresponde a medir las dimensiones de un cubo que mide 1 m de largo, 1 m de ancho y 1 m de alto.
La temperatura influye directamente sobre el volumen de los gases y los líquidos:
Medición de Volumen:
Gases Ideales:
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal.
Los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes.
Combinando todas las leyes anteriores se llega a la expresión:
P1 V1 / T1 = P2V2 / T2
|
Que es la ecuación general de los gases ideales.
Si la cantidad de materia que tenemos es 1 mol en condiciones normales (1atm y 0K) ocupará un volumen de 22,4 L. Esto significa que el producto:
P0 V0 / T0 = 1atm·22,4L / 273 Kmol = 0,082 atm L K-1mol-1 = R
Por esta razón y para n moles siendo las condiciones de presión y temperatura cualesquiera podemos poner que:
Ejemplo:
Calcular el volumen de 6,4 moles de un gas a 210ºC sometido a 3 atmósferas de presión.
Solución:
Estamos relacionando moles de gas, presión, temperatura y volumen por lo que debemos emplear la ecuación P · V = n · R · T
V = n · R · T / P = 6,4 · 0,0821 · (273 + 210) / 3 = 84,56 litros LABORATORIO.
martes, 9 de agosto de 2016
OXIDO REDUCCIÓN
UNA REACCIÓN SE CARACTERIZA POR QUE HAY UNA TRASFERENCIA DE ELECTRONES EN DONDE UNA SUSTANCIA GANA ELECTRONES Y OTRA SUSTANCIA PIERDE ELECTRONES.
- LA SUSTANCIA QUE GANA ELECTRONES DISMINUYE SU NUMERO DE OXIDACIÓN, ESTE PROCESO SE LLAMA REDUCCIÓN.
- LA SUSTANCIA QUE PIERDE ELECTRONES AUMENTA SU NUMERO DE OXIDACIÓN, ESTE PROCESO SE LLAMA OXIDACIÓN.
POR LO TANTO LA REDUCCIÓN ES GANANCIA DE ELECTRONES Y LA OXIDACIÓN ES UNA PERDIDA DE ELECTRONES.
NUMERO DE OXIDACIÓN
CORRESPONDE A LA CARGA DEL ELEMENTO QUÍMICO, ES DECIR A UN VALOR QUE SE LE HA ASIGNADO A CADA ELEMENTO QUÍMICO, EL CUAL INDICA LA CANTIDAD DE ELECTRONES QUE PODRÍA GANAR, PERDER O COMPARTIR CUANDO SE FORMA UN COMPUESTO.
COMO SE CALCULA EL NUMERO
DE OXIDACIÓN
DE OXIDACIÓN
PASO 1: EL NUMERO DE OXIDACIÓN DE CUALQUIER ÁTOMO EN ESTADO LIBRE O FUNDAMENTAL ES DECIR NO COMBINADO ES CERO.
PASO 2: EL NUMERO DE OXIDACIÓN DEL HIDRÓGENO EN +1, EXCEPTO EN EL CASO DE LOS HIDRUROS QUE ES -1.
EJEMPLO: HCL; ÁCIDO CLORHÍDRICO
NUMERO DE OXIDACIÓN DEL HIDRÓGENO +1
NUMERO DE OXIDACIÓN DEL CLORO -1
HL; ÁCIDO YODHIDRICO
NUMERO DE OXIDACIÓN DEL HIDRÓGENO +1
NUMERO DE OXIDACIÓN DEL CLORO -1
PASO 3: EL NUMERO DE OXIDACIÓN DEL OXIGENO ES -2 EXCEPTO EN LOS PERÓXIDOS DONDE ES -1.
EJEMPLO: CaO; OXIDO DE CALCIO
NUMERO DE OXIDACIÓN DEL OXIGENO -2
NUMERO DE OXIDACIÓN DEL CALCIO +2
H2O2; PERÓXIDO DE HIDRÓGENO
NUMERO DE OXIDACIÓN DEL OXIGENO -1
NUMERO DE OXIDACIÓN DEL HIDRÓGENO +1
PASO 4: LOS METALES TIENEN UN NUMERO DE OXIDACIÓN POSITIVO (+) E IGUAL A SU VALENCIA .
EJEMPLO: Ca, VALENCIA=2
NUMERO DE OXIDACIÓN=+2
PASO 5: LOS NO METALES TIENEN NUMERO DE OXIDACIÓN NEGATIVO (-) E IGUAL A SU VALENCIA.
EJEMPLO: I, VALENCIA= 1
NUMERO DE OXIDACIÓN= -1
PASO 6: EN COMPUESTOS , EL NUMERO DE OXIDACIÓN DEL FLÚOR ES SIEMPRE -1 .
EJEMPLO: NaF; FLUORURO DE SODIO
NUMERO DE OXIDACIÓN DEL FLÚOR -1
NUMERO DE OXIDACIÓN DEL SODIO +1
PASO 7: EN LAS MOLÉCULAS NEUTRAS, LA SUMA DE LOS NÚMEROS E OXIDACIÓN DE CADA UNO DE LOS ÁTOMOS QUE LA FORMAN ES IGUAL A 0.
PASO 8: LA MOLÉCULA TIENE UNA CARGA DE -3 POR LO TANTO AL SUMAR LOS NÚMEROS DE OXIDACIÓN DEL FÓSFORO Y DEL OXIGENO, EL RESULTADO DEBE SER IGUAL A -3.
BALANCEO DE ECUACIONES
JUEGO
Suscribirse a:
Entradas (Atom)