nomenclatura de óxidos
un oxido compuesto binario formado por oxigeno y otros elementos existen una gran variedad de óxidos los cuales se presentan los tres principales estados de la materia solido liquido y gaseoso casi todos los elementos forman combinaciones estables con el oxigeno y muchos varios estados de oxidación .
NOMENCLATURA TRADICIONAL
toma en cuenta los estados de oxidación del elemento.
cuando un elemento solo tiene un estado de oxidación se nombra oxido mas el nombre de el elemento
EJEMPLO:
CaO = oxido de calcio
ca tiene como numero de estado de oxidación 2
y oxigeno tiene como numero de estado de oxidación -2
cuando un elemento tiene dos estados de oxidación se nombra oxido mas el elemento y el sufijo oso
por que tomamos el estado de oxidación menor
Bi2O3 = oxido de bismuto
Bi tiene como estado de oxidación 3
y oxigeno tiene como numero de oxidación -2
cuando tomemos el estado de oxidación mayor:
es oxido mas el elemento y el sufijo ico
Bi2O5 = oxido de bismuto
Bi tiene como estado de oxidación 5
y oxigeno -2
cuando un elemento tiene tres estados de oxidación
si se toma el estado de oxidación menor seria así
oxido mas el prefijo ico mas el nombre del elemento y el sufijo oso
EJEMPLO
P2O3= oxido hipofosforoso
p tiene como estado de oxidación 3
y oxigeno -2
si se toma el estado de oxidación intermedio
se pone oxido mas el nombre de el elemento y el sufijo oso
EJEMPLO
PO2= oxido fosforoso
p tiene como estado de oxidación 4
y oxigeno -2
si se toma el estado de oxidación menor
se pone oxido mas el nombre de el elemento y el sufijo ico
EJEMPLO
P2O5= oxido fosforico
p tiene como estado de oxidación 5
y oxigeno -2
cuando tiene cuatro estados de oxidación
si se toma el estado de oxidación menor
se pone oxido mas prefijo hipo mas el nombre de el elemento y el sufijo oso
EJEMPLO
Cl2O= oxido hipocloroso
Cl tiene como estado de oxidación 1
y oxigeno tiene -2
si se toma el estado de oxidación intermedio menor
se pone oxido mas nombre de el elemento y el sufijo oso
EJEMPLO
CL2O3= oxido cloroso
Cl tiene como estado de oxidación 3
y oxigeno tiene -2
si se toma el numero de oxidación intermedio mayor
se pone oxido mas el nombre de el elemento y el sufijo ico
EJEMPLO
Cl2O5= oxido clorico
Cl tiene como numero de oxidación 5
y oxigeno tiene -2
si se toma el estado de oxidación mayor
se pone oxido mas el prefijo per mas el nombre de el elemento mas el sufijo ico
EJEMPLO
Cl2O7= oxido perclorico
Cl tiene como estado de oxidación 7
y oxigeno tiene -2
NOMENCLATURA SISTEMÁTICA
EJEMPLOS
Tiene en cuenta el numero de moléculas de cada elemento
se pone prefijo oxido de mas prefijo y el nombre de el elemento
y el prefijo depende del numero de moléculas que tenga el elemento
N2O3=trioxido de dinitrogeno
S2O4=tetraoxido de diazufre
Li2O=oxido de dilitio
Se2O4=tetraoxido de diselenio
Al2O3=trioxido de dialuminio
NOMENCLATURA STOCK
EJEMPLOS
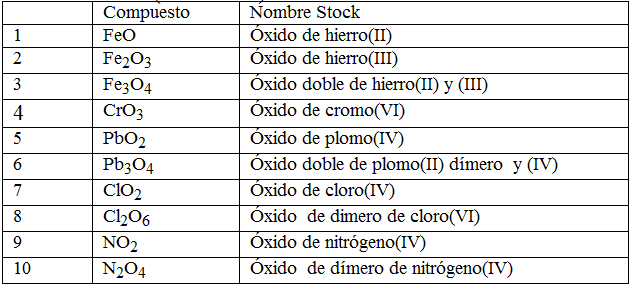
esta tiene en cuenta los estados de oxidación de los elementos sin contar el oxigeno
se pone oxido de mas el nombre de el elemento y el estado de oxidación de el elemento
EJEMPLO
CaO= oxido de calcio (II)
por que Ca tiene como estado de oxidación 2
Bi2O5= oxido de bismuto (v)
por que Bi tiene como estado de oxidación 5
un oxido compuesto binario formado por oxigeno y otros elementos existen una gran variedad de óxidos los cuales se presentan los tres principales estados de la materia solido liquido y gaseoso casi todos los elementos forman combinaciones estables con el oxigeno y muchos varios estados de oxidación .
NOMENCLATURA TRADICIONAL
toma en cuenta los estados de oxidación del elemento.
cuando un elemento solo tiene un estado de oxidación se nombra oxido mas el nombre de el elemento
EJEMPLO:
CaO = oxido de calcio
ca tiene como numero de estado de oxidación 2
y oxigeno tiene como numero de estado de oxidación -2
cuando un elemento tiene dos estados de oxidación se nombra oxido mas el elemento y el sufijo oso
por que tomamos el estado de oxidación menor
Bi2O3 = oxido de bismuto
Bi tiene como estado de oxidación 3
y oxigeno tiene como numero de oxidación -2
cuando tomemos el estado de oxidación mayor:
es oxido mas el elemento y el sufijo ico
Bi2O5 = oxido de bismuto
Bi tiene como estado de oxidación 5
y oxigeno -2
cuando un elemento tiene tres estados de oxidación
si se toma el estado de oxidación menor seria así
oxido mas el prefijo ico mas el nombre del elemento y el sufijo oso
EJEMPLO
P2O3= oxido hipofosforoso
p tiene como estado de oxidación 3
y oxigeno -2
si se toma el estado de oxidación intermedio
se pone oxido mas el nombre de el elemento y el sufijo oso
EJEMPLO
PO2= oxido fosforoso
p tiene como estado de oxidación 4
y oxigeno -2
si se toma el estado de oxidación menor
se pone oxido mas el nombre de el elemento y el sufijo ico
EJEMPLO
P2O5= oxido fosforico
p tiene como estado de oxidación 5
y oxigeno -2
cuando tiene cuatro estados de oxidación
si se toma el estado de oxidación menor
se pone oxido mas prefijo hipo mas el nombre de el elemento y el sufijo oso
EJEMPLO
Cl2O= oxido hipocloroso
Cl tiene como estado de oxidación 1
y oxigeno tiene -2
si se toma el estado de oxidación intermedio menor
se pone oxido mas nombre de el elemento y el sufijo oso
EJEMPLO
CL2O3= oxido cloroso
Cl tiene como estado de oxidación 3
y oxigeno tiene -2
si se toma el numero de oxidación intermedio mayor
se pone oxido mas el nombre de el elemento y el sufijo ico
EJEMPLO
Cl2O5= oxido clorico
Cl tiene como numero de oxidación 5
y oxigeno tiene -2
si se toma el estado de oxidación mayor
se pone oxido mas el prefijo per mas el nombre de el elemento mas el sufijo ico
EJEMPLO
Cl2O7= oxido perclorico
Cl tiene como estado de oxidación 7
y oxigeno tiene -2
NOMENCLATURA SISTEMÁTICA
EJEMPLOS
Tiene en cuenta el numero de moléculas de cada elemento
se pone prefijo oxido de mas prefijo y el nombre de el elemento
y el prefijo depende del numero de moléculas que tenga el elemento
- mono
- di
- tri
- tetra
- penta
- sexta
- hecta
- octa
- nona
- deca
N2O3=trioxido de dinitrogeno
S2O4=tetraoxido de diazufre
Li2O=oxido de dilitio
Se2O4=tetraoxido de diselenio
Al2O3=trioxido de dialuminio
NOMENCLATURA STOCK
EJEMPLOS

esta tiene en cuenta los estados de oxidación de los elementos sin contar el oxigeno
se pone oxido de mas el nombre de el elemento y el estado de oxidación de el elemento
EJEMPLO
CaO= oxido de calcio (II)
por que Ca tiene como estado de oxidación 2
Bi2O5= oxido de bismuto (v)
por que Bi tiene como estado de oxidación 5
ACTIVIDADES DE NOMENCLATURA DE OXIDOS
TEORÍA
NOMENCLATURA DE HIDRACIDOS
TEORIA
Es un ácido que no contiene oxigeno son combinaciones binarias entre hidrógeno entre los halogenos
FORMULACIÓN DE LOS HIDRACIDOS
las formulas de los hidracidos son del siguiente tipo HnX( donde x es el elemento no metálico y n es la valencia de dicho elemento.
la nomenclatura de los hidracidos diferencia las sustancias gaseosas de sus soluciones acidas en el caso del floruro de hidrogeno (acido fluorhidrico) la molecula se suele representar como HF sin embargo realmente la estructura atomica de esta molecula responde a dos atomos de cada elemto H2F2.
EJEMPLO
Hl(aq)Acido yodhidrico
HF(aq) Acido fluoridrico
NOMENCLATURA OXOACIDOS
TEORÍA
TABLA DE LOS AXOACIDOS MAS COMUNES

Los oxoacidos son combinaciones ternarias formadas por hidrógeno un elemento no metal y el oxigeno (en ocasiones puede ser un elemento metálico del grupo del cromo ,magnesio wolframio o el vanadio ya que actúan como no metálicos en alto estado de oxidación.
FORMULACIÓN DE LOS OXACIDOS
La formula general de los oxacidos es HaXbOc donde el hidrógeno actúan con números de oxidación
,el oxigeno actúa con numero de oxidación -2.y el números de oxidación y el numero de oxidación del elemento no metalico se calcula según la siguiente formula:
x = (2c-a)/b
NOMENCLATURA DE LOS OXOACIDOS
Para la nomenclatura de los oxoacidos puede utilizarse la nomenclatura tradicional, nomenclatura de stock asi como la nomenclatura sistematica.




























